Les spectres d'émission
Quand la matière produit de la lumière
Tout matériau, lorsqu'il est chaud, a tendance à émettre de la lumière. On peut facilement s'en rendre compte de nos jours avec l'élément d'une cuisinière, le filament de métal d'une ampoule électrique ou le Soleil, par exemple.
À la fin des années 1800, les scientifiques observent également le phénomène en chauffant des substances dans leurs laboratoires, mais ignorent comment l'expliquer. Ils savent néanmoins décomposer la lumière émise par un gaz en un spectre dont les raies sont caractéristiques des éléments chimiques qu'il contient. En 1859, le physicien allemand Gustav Robert Kirchhoff baptise d'ailleurs ce type de spectre, « spectre d'émission ».
Plusieurs chercheurs vont tenter d'expliquer comment de la matière peut générer un spectre d'émission mais sans succès. C'est en 1900, que le physicien allemand Max Planck va fournir une partie de la réponse.
Planck constate d'abord qu'en utilisant la physique de l'époque, il est impossible de venir à bout du problème. Il élabore alors une théorie révolutionnaire qui va marquer rien de moins que le début de la physique moderne et la fin de la physique qui l'a jusqu'alors précédée.
Dans sa théorie, Planck affirme que la lumière ne peut être émise que par petits paquets d'énergie qu'il nomme « quanta » et qu'on rebaptisera un peu plus tard « photons ». Une telle proposition est contraire à tout ce que l'on sait de la lumière à l'époque.
En effet, la lumière est alors considérée comme une forme d'énergie continue qui se propage sous l'apparence d'une onde électromagnétique et non comme une forme d'énergie discontinue, tel que le suppose l'existence des photons qui sont des particules.
Entre alors en scène le physicien allemand Albert Einstein, en 1905. Non seulement donne-t-il raison à Planck, mais il va plus loin : il propose qu'en plus de se comporter à l'occasion comme une particule (un photon), la lumière garde un caractère ondulatoire et qu'il faut véritablement la considérer à la fois comme une particule et comme une onde.
De plus, Einstein établit que l'énergie d'un photon est reliée à la longueur d'onde de sa radiation. Ainsi, selon lui, les ondes ayant de grandes longueurs d'onde (comme la lumière rouge) transportent peu d'énergie, tandis que celles qui ont de courtes longueurs d'onde (comme la lumière violette) véhiculent plus d'énergie.
En 1913, le physicien danois Niels Henrik David Bohr intègre les avancées de Planck et Einstein à son nouveau modèle de l'atome et explique comment la matière peut émettre de la lumière sous forme de particules. Selon Bohr, l'atome est fait d'électrons chargés négativement qui orbitent autour d'un noyau chargé positivement. Cependant, les orbitales des électrons sont situées à des distances bien spécifiques du noyau.
L'électron se trouvant sur une orbite proche du noyau a relativement peu d'énergie; il est en effet solidement retenu par le noyau positif qui l'attire. On devra donc lui fournir beaucoup d'énergie pour le faire passer à une orbitale supérieure. L'électron qui occupe une position éloignée a quant à lui beaucoup d'énergie, car pour demeurer en orbite, il doit compenser pour la grande distance le séparant du noyau qui cherche à exercer sur lui sa force d'attraction. On devra donc lui fournir peu d'énergie pour le faire passer à une orbitale supérieure.
D'après Bohr, lorsqu'un corps est chauffé, certains de ses électrons absorbent de l'énergie et ont tendance à passer rapidement d'une orbitale rapprochée à une orbitale plus éloignée du noyau atomique. Chaque électron revient ensuite de lui-même à son orbitale d'origine, située proche du noyau, en réduisant son contenu en énergie de façon à le faire correspondre exactement à celui de son orbitale d'origine.
Bohr propose que c'est sous la forme de petits « paquets d'énergie » tels que décrits par Planck et Einstein, c'est-à-dire sous la forme de photons et donc de lumière, qu'un électron se débarrasse de son surplus d'énergie.
Comme chaque élément chimique possède un noyau atomique de charge positive distincte, les orbitales de ses électrons ont par conséquent toutes des contenus énergiques différents. En passant d'une orbitale éloignée à une orbitale plus rapprochée, l'électron d'un élément chimique donné émet un photon qui lui est caractéristique et dont l'énergie correspond à la longueur d'onde de la lumière observée dans son spectre d'émission.
Compte tenu du fait que plusieurs sauts d'orbitales sont possibles au sein d'un atome, chaque élément chimique possède son propre spectre de raies d'émission qui lui est unique.
La figure suivante montre le spectre d'émission de quelques éléments chimiques. Il est facile de constater que tous ont des raies d'émission qui leurs sont caractéristiques, comme un code barres ou une empreinte digitale.

Spectre d'émission de l'hydrogène.
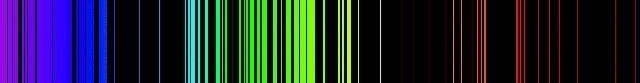
Spectre d'émission du fer.


